PCTI 223. Potencial de glucanos para estimular el sistema inmune de terneras recién nacidas
Carlos Angulo
Autor de Correspondencia
Dr. Héctor Nolasco Soria
Editor
29/08/2023
Fecha de Aprobación
Biotecnología y Ciencias Agropecuarias
Categoría
Autores
Carlos Angulo, Miriam Angulo
Centro de Investigaciones Biológicas del Noroeste, S.C. (CIBNOR), Grupo de Inmunología y Vacunología. Instituto Politécnico Nacional 195, Playa Palo de Santa Rita Sur, La Paz B.C.S. 23096, México. eangulo@cibnor.mx
La mayor mortalidad de los bovinos lecheros ocurre en el periodo neonatal, que es durante los primeros 30 días después del nacimiento y es principalmente asociada a infecciones.
Abstract
This study evaluated the effect of oral administration of a carbohydrate (beta-glucan) from the yeast Debaryomyces hansenii CBS 8339 on the immune response in newborn calves. The calves received two doses of 5 mg per kg of weight, separated by three days (on days 0 and 3). On day 7 a blood sample was taken to analyze the immune response and protection against an infectious challenge in monocytes with the pathogen Escherichia coli. After the infection challenge, phagocytic activity, nitric oxide production, myeloperoxidase activity, and expression of genes associated with the immune response increased in calves receiving beta-glucan. These results indicate that beta-glucan from D. hansenii CBS 8339 stimulated the defenses of newborn calves and could help protect them from infections.
Keywords: functional carbohydrates, immune defenses, infections, animal health.
Resumen
En este estudio se evaluó el efecto de la administración oral de un carbohidrato (beta-glucano) de la levadura Debaryomyces hansenii CBS 8339 sobre la respuesta inmune en becerras recién nacidas. Las becerras recibieron dos dosis de 5 mg por kg de peso, separadas por tres días (al día 0 y 3). Al día 7 se tomó una muestra de sangre para analizar la respuesta inmune y la protección contra un reto infeccioso en monocitos con el patógeno Escherichia coli. Después del reto infeccioso, la actividad fagocítica, la producción de óxido nítrico, la actividad de la mieloperoxidasa y la expresión de genes asociados a la respuesta inmune se incrementaron en las becerras que recibieron el beta-glucano. Estos resultados indican que el beta-glucano de D. hansenii CBS 8339 estimuló las defensas de becerras recién nacidas y podría ser útil para protegerlas de infecciones.
Palabras clave: carbohidratos funcionales, inmuno-defensas, infecciones, salud animal.
Problemática
Usuarios
Proyecto
Introducción
La mayor mortalidad de los bovinos lecheros ocurre en el periodo neonatal, que es durante los primeros 30 días después del nacimiento y es principalmente asociada a infecciones (Mee, 2023). La mala higiene de los pesebres, la suciedad en los pezones de las madres y mal calostrado, predisponen a los becerros a infectarse desde las primeras horas de vida. Escherichia coli causa colibacilosis en los establos lecheros, y es resistentes a los antibióticos usados de manera común como tratamiento. En este sentido, el sistema inmune del cuerpo puede ser estimulado por sustancias producidas por levaduras (Schlabitz et al., 2022), principalmente por carbohidratos de tipo beta-glucano, para controlar infecciones por E. coli (Liu et al., 2021; Machuca et al., 2022). Por lo anterior, en este trabajo se investigó el efecto de la administración oral de beta-glucano, obtenido de una levadura marina (Debaryomyces hansenii CBS 8339), sobre la respuesta inmune en becerras Holstein recién nacidas.
Materiales y métodos
Se cultivó Debaryomyces hansenii CBS 8339 en medio YPD (5 g extracto de levadura, 10 g de peptona y 10 g de dextrosa por litro, Sigma, St. Louis MO, USA) a 30 °C en agitación a 150 revoluciones por minuto (r.p.m.) por 24 horas. La biomasa del cultivo se obtuvo por centrifugación (2500 r.p.m. por 15 minutos) y se liofilizó (LABCONCO, MO, USA) durante 24 horas. Posteriormente, la biomasa se incubó con una solución de hidróxido de sodio (3 %) y se calentó a 100 °C por 3 horas. La suspensión se centrifugó (6297 g x 15 min) y se añadió ácido acético (0.5 N) para resuspender el precipitado (75 °C por 6 horas). En seguida, se agregaron 40 mL de etanol y el material se calentó a punto de ebullición por 15 minutos. Por último, se centrifugó para obtener el beta-glucano que fue liofilizado para su uso.
El beta-glucano se administró por vía oral en una solución amortiguadora (PBS) (a 40 mg mL-1) a cinco terneras (becerras) Holstein de uno a cinco días de nacidas (Grupo beta-glucano de D. hansenii CBS 8339); en un esquema de dos dosis separadas por tres días (Fig. 1), cada dosis fue de 5 miligramos por kilogramo de peso vivo. Cinco becerras sólo recibieron 5 mililitros de la solución amortiguadora en dos dosis (grupo Control). Al día 7 se tomó una muestra de sangre para aislar monocitos (células del sistema inmune). Un millón de monocitos (1 × 106 cel mL-1) se cultivaron en placas por 12 horas a 37 °C con CO2 (5 %), luego fueron infectados con la bacteria patógena Escherichia coli 25 (1 × 108 UFC mL-1) y se volvieron a incubar por 4 y 24 horas a 37 °C. A las 4 y 24 horas se tomaron muestras para analizar la expresión de genes y parámetros asociados al sistema inmune. Los parámetros inmunes estudiados con técnicas convencionales fueron la actividad fagocítica (Teng et al. 2015), la producción de óxido nítrico (Neumann et al., 1995), y la actividad de la mieloperoxidasa (Quade y Roth, 1997). Los genes analizados por el método de Livak y Schmittgen (2001) fueron el receptor TLR2 (tlr2), el factor de transcripción NF-kB (nfκb), y la citocina TNF-a (tnf-α).
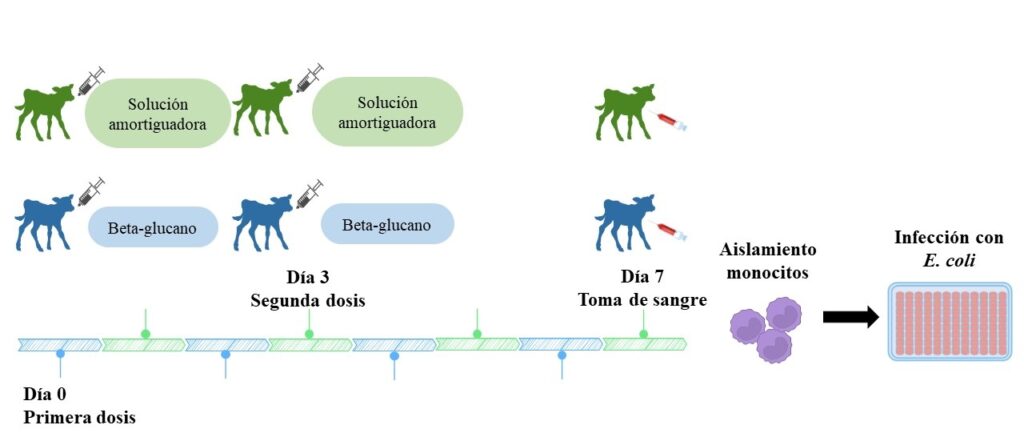
Figura 1. Esquema de administración de los beta-glucanos de Debaryomyces hansenii CBS 8339 en terneras Holstein recién nacidas.
Resultados y discusión
El sistema inmune de rumiantes madura hasta el primer año de vida (Colditz et al., 1996), por lo que la estimulación en el primer mes de vida puede ayudar a combatir enfermedades infecciosas, como la colibacilosis. Después de la infección con el patógeno (E. coli 25), la actividad fagocítica, la producción de óxido nitrico y la actividad mieloperoxidasa aumentaron de forma estadísticamente significativa (p < 0.05) en los monocitos de las terneras que recibieron vía oral el beta-glucano de D. hansenii CBS 8339, en comparación con los parámetros evaluados en los monocitos de las becerras del grupo Control que sólo recibieron la solución amortiguadora (PBS) (Fig. 2).
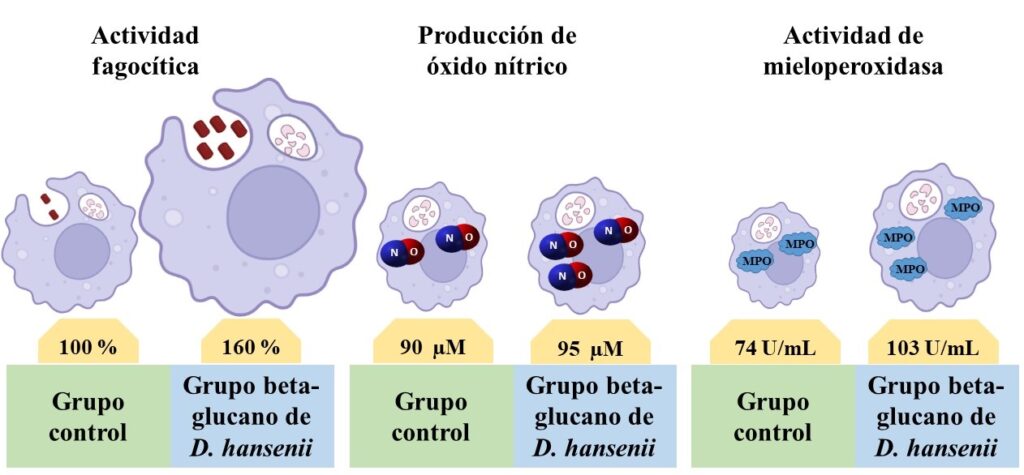
Figura 2. Respuesta de parámetros inmunológicos (fagocitosis, producción de óxido nítrico y actividad mieloperoxidasa) en monocitos de terneras que recibieron vía oral el beta-glucano de D. hansenii CBS 8339 y en monocitos del grupo Control. Los monocitos fueron infectados con E. coli 25.
La actividad fagocítica consiste en la habilidad de los monocitos para comerse a los patógenos y destruirlos (digerirlos) en su interior (Hussen y Schuberth, 2017). Para destruirlos, los monocitos producen óxido nítrico, que es una molécula tóxica para los patógenos (MacMicking et al., 1997). Además, la enzima mieloperoxidasa dentro de los monocitos genera ácido hipocloroso con actividad microbicida (mata a los microbios) (Aratani, 2018). Es decir, los resultados indican que los monocitos de las becerras suplementadas con el beta-glucano de D. hansenii CBS 8339 tuvieron una mayor capacidad de defensa inmune para eliminar al patógeno E. coli 25.
La expresión de genes es un proceso en el cual la información contenida en un gen se transmite a moléculas de ácido ribonucleico (ARN) mediante el proceso de transcripción que indica cuanto y cuándo se sintetizarán proteínas en el proceso de traducción. La expresión de los genes tlr2, nfκb, y tnf-α se incrementó significativamente (p < 0.05) después de la infección con el patógeno (E. coli 25) en los monocitos de las becerras del grupo beta-glucano de D. hansenii CBS 8339 en comparación al nivel de expresión de esos genes en los monocitos de las becerras del grupo Control (Fig. 3).
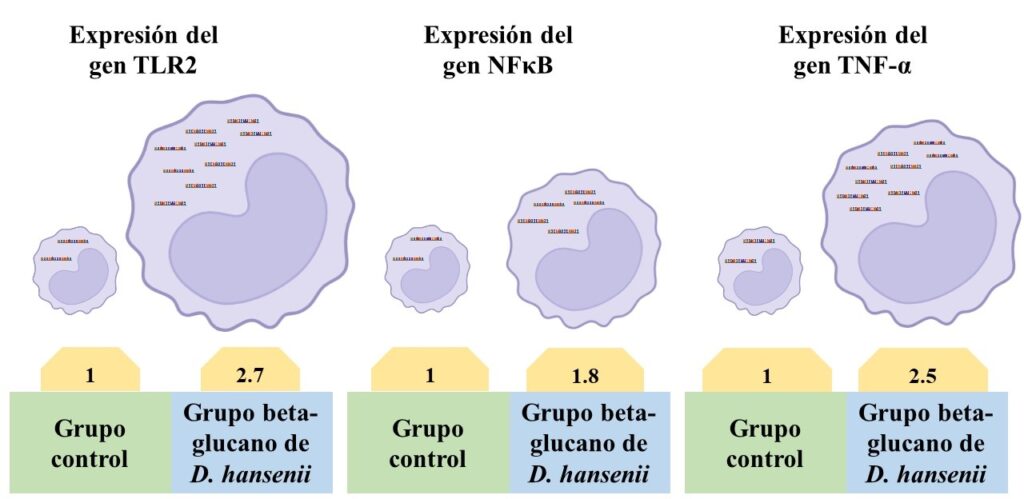
Figura 3. Comparación de los niveles de expresión de genes asociados al sistema inmune (TLR2, NFκB y TNF-α). Incrementados (p < 0.05) en monocitos de terneras que recibieron vía oral el beta-glucano de D. hansenii CBS 8339 contra los del grupo control. Los monocitos fueron infectados con E. coli 25.
El TLR2 (tlr2) es un receptor de glucanos y se encuentra en la superficie de los monocitos (Takeda y Akira, 2004). Al reconocer el beta-glucano de D. hansenii CBS 8339, el TLR2 manda la señal para que se active el nfκb que se encuentra en el citoplasma de los monocitos. Posteriormente, el nfκb se introduce al núcleo y se une al ADN para activar la transcripción del tnf-α (Takeda y Akira, 2004). Finalmente, el tnf-α se encarga de estimular a los monocitos para aumentar la potencia de sus funciones, como son la producción de óxido nítrico y la actividad mieloperoxidasa, entre otras (Idriss y Naismith, 2000; Kushibiki, 2011). De esta manera se puede explicar el mecanismo de inmuno-estimulación de los monocitos de becerras administradas oralmente con beta-glucano de D. hansenii CBS 8339.
Conclusiones
Los resultados indican que la administración del beta-glucano de Debaryomyces hansenii CBS 8339 estimuló las defensas de becerras recién nacidas, con efectos positivos tanto de parámetros inmunológicos (fagocitosis, producción de óxido nítrico y actividad mieloperoxidasa), como en la expresión de genes (tlr2, nfκb, y tnf-α) que, en todos los casos, están asociados directamente con el sistema inmune y su respuesta ante patógenos.
Impacto Socioeconómico
La mortalidad de becerras por diarreas infecciosas causadas por E. coli reduce el número de hembras de reemplazo, pero aquellos animales que enfermaron y sobrevivieron gracias al uso de antibióticos, serán animales problema por el resto de su vida productiva, por lo que, la administración de beta-glucanos de D. hansenii CBS 8339 que ayudan al sistema inmune, puede ser una alternativa viable.
Referencias
Neumann NF, Fagan D, Belosevi M (1995) Macrophage activating factor (s) secreted by mitogen stimulated goldfish kidney leukocytes synergize with bacterial lipopolysaccharide to induce nitric oxide production in teleost macrophages. Developmental Comparative Immunology, 19: 473– 482.
Livak KJ, Schmittgen TD (2001) Analysis of relative gene expression data using realtime quantitative PCR and the 2−ΔΔCT method. Methods, 25: 402–408.
Takeda K, Akira S (2004) TLR signaling pathways. Seminars in immunology, 16: 3–9.
Hussen J, Schuberth HJ (2017) Heterogeneity of Bovine Peripheral Blood Monocytes. Frontiers Immunology, 19: 1875.
MacMicking J, Xie QW, Nathan C (1997) Nitric oxide and macrophage function. Annual review of immunology, 15: 323–50.
Aratani Y (2018) Myeloperoxidase: Its role for host defense, inflammation, and neutrophil function. Archives of biochemistry and biophysics, 640: 47–52.
Mee JF (2023). Invited review: Bovine neonatal morbidity and mortality-Causes, risk factors, incidences, sequelae and prevention. Reproduction in Domestic Animals.
Machuca C, Méndez-Martínez Y, Reyes-Becerril M, Angulo C (2022) Yeast β-Glucans as Fish Immunomodulators: A Review. Animals, 12: 2154.
Schlabitz C, Lehn, DN, de Souza CFV (2022) A review of Saccharomyces cerevisiae and the applications of its byproducts in dairy cattle feed: Trends in the use of residual brewer’s yeast. Journal of Cleaner Production, 332: 130059.
Liu Y, Wu Q, Wu X, Algharib SA, Gong F, Hu J, Luo W, Zhou M, Pan Y, Yan Y, Wang Y (2021) Structure, preparation, modification, and bioactivities of β-glucan and mannan from yeast cell wall: A review. International journal of biological macromolecules, 173: 445–456.
Colditz IG, Watson DL, Gray GD, Eady SJ (1996) Some relationships between age, immune responsiveness and resistance to parasites in ruminants. International journal for parasitology, 26: 869–877.
Kushibiki S (2011) Tumor necrosis factor-α-induced inflammatory responses in cattle. Animal Science Journal, 82: 504-511.
Idriss HT, Naismith JH (2000) TNF alpha and the TNF receptor superfamily: structure-function relationship(s). Microscopy research and technique, 50: 184–195.
Teng L, Fu H, Wang M, (2015) Stimulation of RAW264. 7 macrophages by sulfated Escherichia coli K5 capsular polysaccharide in vitro. Molecular Medicine Reports, 12: 5545–5553.
Quade MJ, Roth JA (1997) A rapid, direct assay measures degranulation of bovine neutrophil primary granules. Veterinary immunology and immunopathology, 58: 239–248.
