PCTI 208. Uso de fertilizantes agrícolas en la producción de la microalga Nannochloropsis salina para su aprovechamiento en acuicultura
Daniel Badillo-Zapata
Autor de Correspondencia
Dr. Héctor Nolasco Soria
Editor
04/06/2022
Fecha de Aprobación
Biotecnología y Ciencias Agropecuarias
Categoría
Autores
Aguilar-Reynaga Guadalupe Abigail1, Vega-Villasante Fernando1, Guerrero-Galván Saul Rogelio1, Vargas-Ceballos Manuel1, Badillo-Zapata Daniel1, 2,*
1Laboratorio de Calidad de Agua y Acuicultura Experimental, Departamento de Ciencias Biológicas, Centro Universitario de la Costa (CUCOSTA), Universidad de Guadalajara, Av. Universidad de Guadalajara no. 203, Del. Ixtapa, C.P. 4 8280, Puerto Vallarta, Jalisco, México. 2 Cátedras CONACYT, México, DF. danielbad00@hotmail.com
El uso de fertilizantes agrícolas resuelve ambas limitantes que se tienen cuando se utiliza el medio F/2 de Guillard.
Abstract
In aquaculture, one of the significant challenges is feeding the larval stages of fish, crustaceans, and mollusks, where microalgae are the first link in the food chain. The use of commercial agricultural fertilizers in the growth of the microalgae Nannochloropsis salina was evaluated for its potential use in aquaculture. Different fertilizers were supplied in equal amounts of nutrients (Nitrogen: Phosphorus: Potassium); temperature (26.0±1.0 oC) and light (1600 luxes) were constant 24 hours a day. The treatments were performed in triplicate. As a result, Bayfolan forte® was the agricultural fertilizer with the highest cell concentration (1.5×108 cells•mL-1) on day 13, while Gro-Green® and Nitrofoska Azul® had concentrations of 7.2×107 and 1.3×108 cells•mL-1 on days 47 and 54, respectively.
Keyword: microalgae, fertilizers, Nannochloropsis salina
Resumen
En acuicultura, uno de los grandes retos es la alimentación en etapas larvales de peces, crustáceos y moluscos, donde las microalgas son indispensables. Se evaluó el uso de fertilizantes agrícolas comerciales en el crecimiento de la microalga Nannochloropsis salina para su potencial uso en acuicultura. Se suministraron diferentes fertilizantes en concentraciones iguales de los nutrientes (Nitrógeno: Fosforo: Potasio), la temperatura (26.0±1.0 oC) y la luz (1600 luxes) fueron constantes las 24 horas del día. Los tratamientos se realizaron por triplicado. Como resultado Bayfolan forte® fue el fertilizante agrícola con la mayor concentración celular de N. salina (1.5×108 cel• mL-1) al día 13, mientras que Gro-Green® y Nitrofoska Azul® tuvieron concentraciones de 7.2×107 y 1.3×108 cel•mL-1 al día 47 y 54, respectivamente.
Palabras clave: microalgas, fertilizantes, Nannochloropsis salina
Problemática
Usuarios
Proyecto
Introducción
Las microalgas son organismos microscópicos fotosintéticos que crecen en agua dulce, salobre y salada; su productividad depende de varios factores como pH, temperatura, salinidad, luz, nutrientes, entre otros (Mayorga y Manso, 2017). En el ambiente natural las condiciones ambientales (temperatura, pH, salinidad) modifican la velocidad de crecimiento poblacional de las microalgas (Martínez, 2008). En el cultivo en lote en el laboratorio, se reconocen diferentes fases de crecimiento: a) fase de adaptación, b) aceleramiento, c) crecimiento exponencial, d) desaceleración o crecimiento lento, e) crecimiento estacionario y f) fase de muerte (Fig. 1) (Arredondo y Voltolina, 2007).
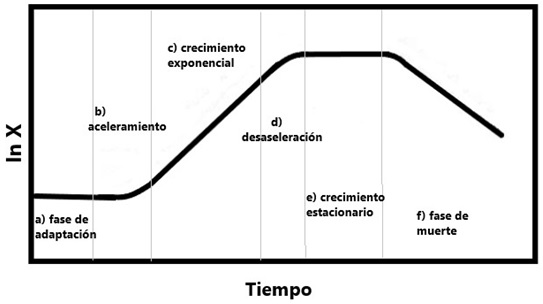
Figura 1. Curva de crecimiento típica para una población de microalgas, en la cual se indican las diferentes fases. Número logarítmico de la cantidad de células de microalgas en el cultivo (modificada de Arredondo y Voltolina, 2007).
Estas fases de crecimiento describen como cambia la concentración celular, la biomasa y la composición bioquímica de las microalgas (Amat et al., 1992; Sánchez-Torres et al., 2008; Montez-González, 2014). En los últimos años, la importancia y el uso de Nannochloropsis salina, aumentó considerablemente por sus propiedades nutricionales, ya que posee un alto contenido en ácidos grasos de la cadena n3, específicamente en el ácido eicosapentaenoico (EPA), que es de gran importancia en el crecimiento y desarrollo de las larvas de peces, moluscos y crustáceos (Montes-Gonzales, 2014). El uso de fertilizantes agrícolas es una excelente opción como medio de cultivo para el crecimiento de microalgas esto por que presentan una gran eficiencia y alta asimilación, teniendo una alta productividad en cuanto a biomasa (Gonzales-Muñoz, 2006 y Silva-Benavides, 2016). Por tal motivo se decidió utilizar distintos fertilizantes agrícolas comerciales en el crecimiento y producción de la microalga Nannochloropsis salina para su posible aprovechamiento en la industria acuícola.
Objetivos
Evaluar el efecto del uso de fertilizantes agrícolas en el crecimiento de N. salina para su uso acuícola.
Materiales y métodos
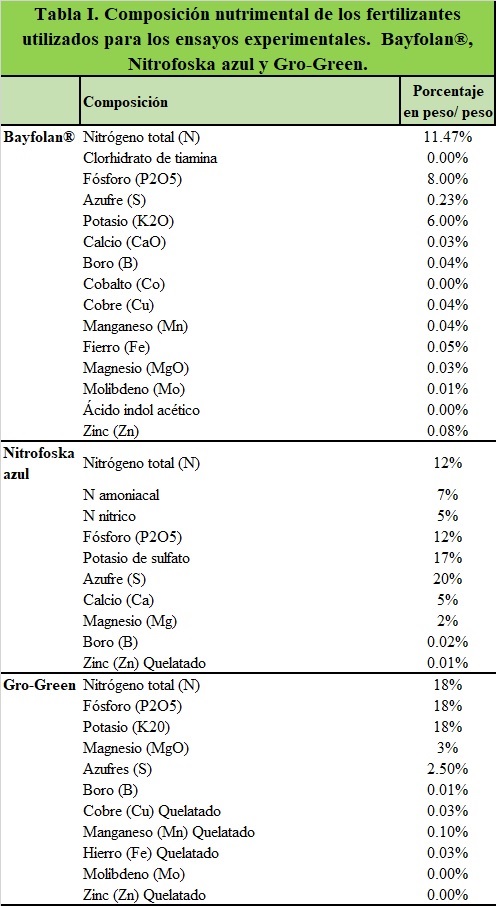
El ensayo experimental se realizó en el Laboratorio de Calidad de Agua y Acuicultura Experimental del CUCOSTA. Se utilizó una cepa de microalga Nannochloropsis salina que nos fue proporcionada por el Laboratorio de Microalgas de la Facultad de Ciencias del Mar (FACIMAR) de la Universidad Autónoma de Sinaloa, unidad Mazatlán, Sinaloa, México. Se mantuvieron características fisicoquímicas, ambientales (salinidad 15 UPS, temperatura 26.0±1.0 oC y de luz 1600 luxes) por 24 hrs. Para la utilización de los fertilizantes se realizó un balance estequiométrico para proveer en la misma concentración los principales nutrientes N12-P8-K6 (Nitrógeno: Fosforo: Potasio). Se utilizaron los tratamientos T1 (Bayfolan forte®), a una concentración de 1.0mL/L de agua, cuya presentación es líquida, el tratamiento T2 (Nitrofoska azul®) en una concentración de 1.0g/L y T3 (Gro-Green®) en una concentración de 0.5g/L estos dos últimos son granulados y el T4 (Blanco) agua destilada preparada a 15 UPS. La composición nutrimental de los fertilizantes (Tabla I). El ensayo tuvo una duración de 54 días. El medio de cultivo se realizó a una salinidad de 15 UPS (Unidades Prácticas de Salinidad) en un volumen de 1L. Cada uno de los tratamientos fue por triplicado y se adicionaron 50 mL de microalga N. salina como inóculo. Se realizó un conteo diario de células•mL-1 con una cámara de Neubauer, en un microscopio óptico marca AmScope®, utilizando la siguiente formula: #cel/mL = Cc x 25 x 1000, donde CC es igual al promedio de células observadas de los cinco cuadros contados en el hematocitómetro de Neubawer, el 25 corresponde a los cuadros centrales y el 1000 corresponde al volumen de donde se tomó la muestra. Los datos del crecimiento de la microalga se sometieron a una prueba de normalidad de Shapiro-Wilk (p <0.05) y de homocedasticidad de Levene (p< 0.05) para determinar si existen diferencias significativas entre los tratamientos y los días de cultivo. Se aplicó un análisis de varianza de una vía (ANOVA) y cuando se detectaron diferencias significativas (p<0.05) entre los tratamientos y se aplicó una prueba a posteriori de Tukey. Todos los análisis estadísticos se realizaron con el programa SigmaPlot 11.0 (SystatSofware, Inc, Chicago, IL, EE.UU.).
Resultados y discusión
El tratamiento T1 y el tratamiento T4 iniciaron con una densidad celular promedio de 1.3×107 ± 1.72×106 células•mL-1. El tratamiento T1 para el día 13 se presentó la mayor contracción con 1.5×108 ± 1.3×107 células•mL-1 y a partir de este día se presentó el decremento en la concentración celular por lo que al día 20 se dio por terminado este tratamiento, debido a que ya se encontraba en la fase de muerte celular. El T4 al tercer día presento el pico más alto 3.5×107 ± 5.8×106 células•mL-1 y para al día 7 se decidió terminarlo por encontrarse en fase de muerte. Para los tratamientos T2 y T3, en el día 1 de cultivo presentaron un promedio celular de 3.5×107 ± 1.5×106 células•mL-1 y para el día 54 el tratamiento T2 presentó la mayor concentración de células con un promedio de 7.2×107 ± 2.1×106 células•mL-1 y para el día 47 el tratamiento T3 alcanzó la mayor concentración con un promedio de 1.3×108 ± 2.6×106 células•mL-1 (Fig. 2).
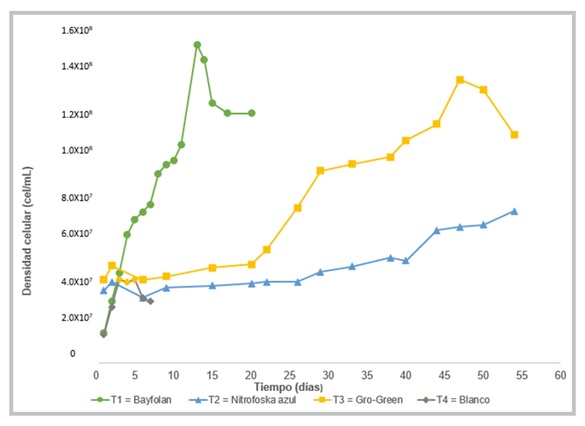
Figura 2. Densidad celular promedio (células•mL-1) de la microalga Nannochloropsis salina de los tratamientos T1, T2, T3 y T4 (Bayfolan, Nitrofoska Azul, Gro-Green y el Blanco).
Actualmente para la producción de distintas especies de microalgas se han comenzado a utilizar fertilizantes de uso agrícola en sustitución de los fertilizantes tradicionales (Silva-Benavides, 2016; Brito et al., 2016;). Brito y col. (2016), evaluaron tres fertilizantes (F/2 de Guillard, Quimifol® y Nitrofoska®) en la producción de la microalga Hyaloraphidium contortum, obtuvieron como resultado que la mayor densidad poblacional, tasa de crecimiento instantáneo y productividad lo tuvieron con el sistema F/2 de Guillard, atribuyen este resultado a que los fertilizantes (Quimifol® y Nitrofoska®) se presentan una forma granulada, lo que podrían presentar una biodisponibilidad retardada en la microalga en comparación con el fertilizante F/2 de Guillar que se encuentra en forma líquida. Así mismo, Mercado-Tupiño (2016) evaluó el efecto de diferentes fertilizantes (Kelpway®, Panteranitro®, Bayfolan forte® y F/2 de Guillard) en el cultivo de la microalga Chaetoceros gracilis, y obtuvo como resultado que el mejor crecimiento celular se dio con el fertilizante Bayfolan forte®. Similares resultados se obtuvieron en el presente experimento ya que Bayfolan forte® se encuentra en forma líquida que permite que tenga una mayor biodisponibilidad para las microalgas, y que Nitrofoska azul y Gro-Green al ser fertilizantes granulados su liberación podría retardar el crecimiento de las células; sin embargo, después de varios días las células se adaptan al fertilizante y empieza su crecimiento. Este proceso de rápida asimilación del fertilizante Bayfolan forte® por las microalgas en la industria acuícola resulta ser muy benéfico porque se refleja en un menor tiempo de cultivo celular y resulta en menor costo comparado con el uso de los otros fertilizantes.
Conclusiones
El fertilizante agrícola Bayfolan forte® fue la mejor opción para producir y cultivar la microalga N. salina ya que obtuvo una mayor concentración celular en un menor tiempo en comparación con otros fertilizantes. Resulta necesario continuar con esta investigación utilizando distintas concentraciones del fertilizante Bayfolan forte® en el cultivo de N. salina.
Impacto Socioeconómico
El impacto socioeconómico se asocia en la producción de microalgas como alimento para las larvas de las distintas especies que se cultivan en acuicultura y el uso del fertilizante agrícola Bayfolan forte® que es un insumo de fácil acceso ayuda a reducir los tiempos de producción y los costos. Bayfolan forte® presentó la mayor concentración celular en el día 13, Nitrofoska azul en el día 54 y gro Green en el día 47, teniendo una diferencia mínima de 34 días entre los tratamientos. Con respecto a los costos este es un aproximado para cada uno, en pesos mexicanos, Bayfolan forte® $110.00, Nitrofoska azul $85.00 y Gro Green $125.00.
Referencias
Amat, F., Hontoria, F., y Navarro, J.C. 1992. Historia de vida de una población experimental de Artemia de Great Salt Lake mantenida en cultivo externo. Larvicultura de Camarones Peneidos, producción de postlarvas, cultivo y evaluación de microorganismos como alimento. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo. CYTED-D., 1:263-271.
Arredondo-Vega, B.O., y Voltolina, D. 2007. Métodos y herramientas analíticas en la evaluación de la biomasa microalgal. Editor Centro de Investigaciones Biológicas del Noroeste. La Paz, B.C.S., México. Capítulo 2: 21-30.
Brito, D. J., Caña, E., Guevara, M., Subero, J., y Colivet, J. 2016. Efecto de tres fuentes de nutrientes en la producción de biomasa y pigmentos de la microalga dulce acuícola Hyaloraphidium contortum. Efecto de tres fuentes de nutrientes en la producción de biomasa y pigmentos de la microalga dulce acuícola Hyaloraphidium contortum, 4(1), 15-26. https://doi.org/10.15741/revbio.04.01.02
Martínez L. 2008. Eliminación de CO2 con microalgas autóctonas. Tesis Doctoral, Instituto de Recursos Naturales, Universidad de León, León, 226 pp.
Mayorga, C., y Manso, L. 2017. Crecimiento de la microalga Dunaliella salina en un cultivador Raceway en condiciones de laboratorio. Revista De Iniciación Científica, 3(1), 85 – 91. Recuperado a partir de https://revistas.utp.ac.pa/index.php/ric/article/view/1702
Mercado-Tupiño, E. 2016. Cultivo de la microalga Scenedesmus Obliquus var. Dimorphus (TURPIN) para la obtención de biomasa y lípidos. (Tesis de maestría), Universidad Ricardo Palma, Lima, Perú.
Montes-Gonzales, O. 2014. Efecto de la intensidad de la Luz y de la tasa de inyección de aire en el crecimiento y la productividad de la microalga Nannochloropsis sp., cultivada en un biorreactor plano. (Tesis de Maestría), Centro de Investigación Científica y de Educación Superior de Ensenada, Baja California
Sánchez-Torres, H., Juscamaita-Morales, J., Vargas-Cárdenas, J., y Oliveros-Ramos, R., 2008. Producción de la microalga Nannochloropsis oculata (Droop) Hibberd en medios enriquecidos con ensilado biológico de pescado. Ecología Aplicada, 7(1-2): 149-158.
Silva-Benavides, A. M. 2016. Evaluación de fertilizantes agrícolas en la productividad de la microalga Chlorella sorokiniana. Agronomía Mesoamericana, 27(2), 265. https://doi.org/10.15517/am.v27i2.24361
Yúfera, M., y Lubián, L. M. 1990. Effects of microalgal diet on growth and development of invertebrates in marine aquaculture. En: Akatsuka, I. (Ed.). Introduction to Applied Phycology. SPB The Academic Publishing, The Hague, pp.209-227.
